Un modo più verde e più semplice per creare syngas
I ricercatori UCLA e Rice sviluppano un nuovo metodo per produrre gas industriale vitale
I ricercatori della UCLA Samueli School of Engineering, Rice University e UC Santa Barbara hanno sviluppato un modo più semplice e più verde per creare syngas.
Uno studio dettagliato del loro lavoro è pubblicato oggi su Nature Energy.
Syngas (il termine è l’abbreviazione di “gas di sintesi”) è una miscela di monossido di carbonio e gas idrogeno. È usato per fare ammoniaca, metanolo, altri prodotti chimici industriali e combustibili. Il processo più comune per la creazione di syngas è la gassificazione del carbone, che utilizza vapore e ossigeno (dall’aria) ad alte temperature, un processo che produce grandi quantità di anidride carbonica.
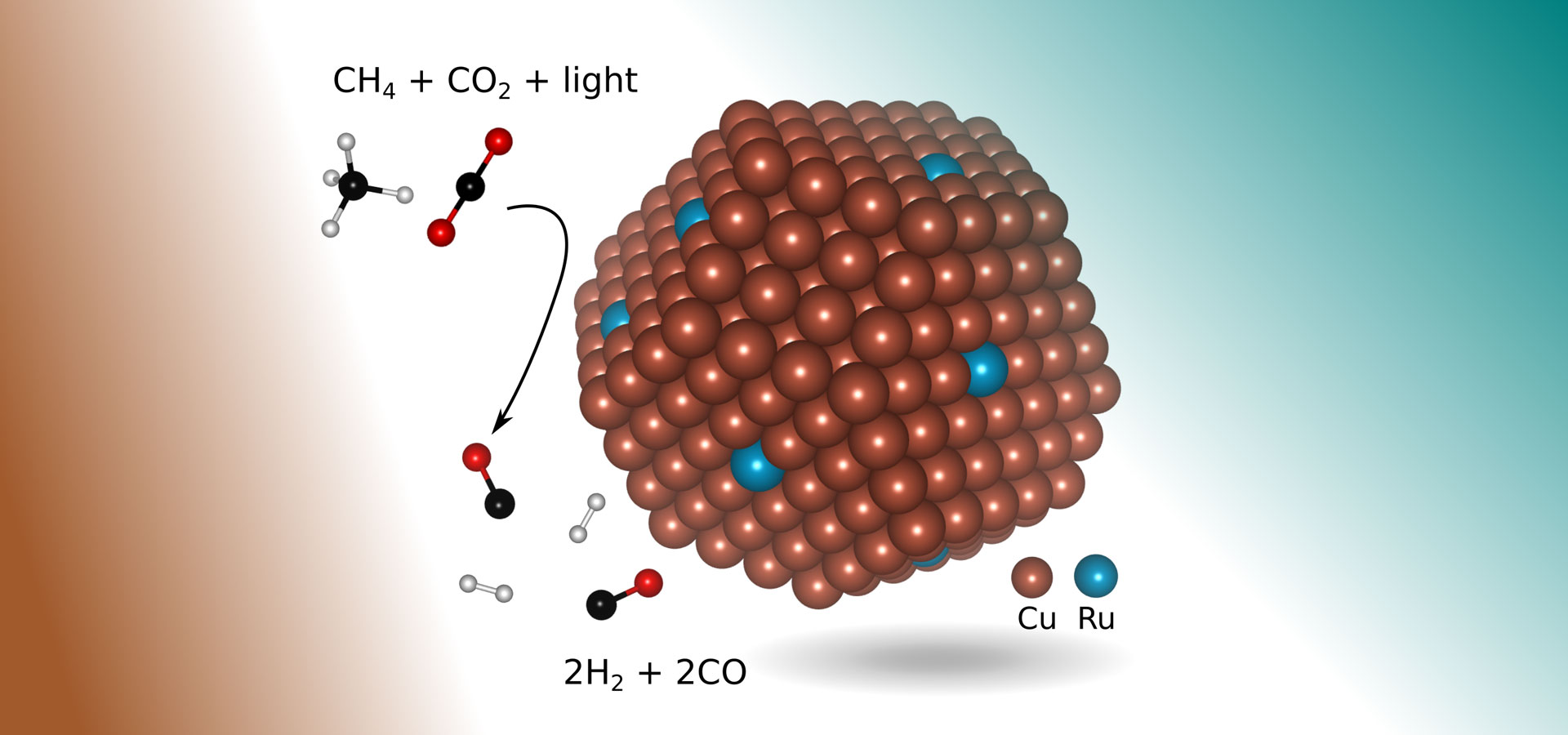
Un altro modo ecologico per creare syngas, chiamato reforming secco del metano, consiste nel far reagire due potenti gas serra: il metano (ad esempio, dal gas naturale) e l’anidride carbonica. Ma questo processo non è ampiamente utilizzato su scala industriale, in parte perché richiede temperature di almeno 1.300 gradi Fahrenheit (700 gradi Celsius) per avviare la reazione chimica.
Negli ultimi dieci anni, i ricercatori hanno cercato di migliorare il processo per la creazione di syngas utilizzando varie leghe metalliche che potrebbero catalizzare la reazione chimica richiesta a temperature più basse. Ma i test erano inefficienti o hanno portato i catalizzatori metallici a essere coperti di coke, un residuo di carbonio per lo più che si accumula durante il processo.
Nella nuova ricerca, gli ingegneri hanno trovato un catalizzatore più adatto: il rame con pochi atomi del metallo prezioso rutenio esposti alla luce visibile. A forma di un piccolo urto di circa 5 nanometri di diametro (un nanometro è un miliardesimo di metro) e sdraiato sulla cima di un supporto di metallo-ossido, il nuovo catalizzatore consente una reazione chimica che produce selettivamente syngas dai due gas serra utilizzando la luce visibile per guidare la reazione, senza richiedere alcun apporto di energia termica supplementare.
Inoltre, in linea di principio, il processo richiede solo luce solare concentrata, che impedisce anche l’accumulo di coke che affliggeva i metodi precedenti.
 “Syngas è utilizzato ubiquitamente nell’industria chimica per creare molte sostanze chimiche e materiali che consentono la nostra vita quotidiana”, ha detto Emily Carter, un professore distinto UCLA di ingegneria chimica e biomolecolare, e un autore corrispondente del documento. “La cosa interessante di questo nuovo processo è che offre l’opportunità di reagire ai gas serra catturati — riducendo le emissioni di carbonio nell’atmosfera — creando questa materia prima chimica critica utilizzando un catalizzatore economico e un’energia rinnovabile sotto forma di luce solare invece di utilizzare combustibili fossili.”
“Syngas è utilizzato ubiquitamente nell’industria chimica per creare molte sostanze chimiche e materiali che consentono la nostra vita quotidiana”, ha detto Emily Carter, un professore distinto UCLA di ingegneria chimica e biomolecolare, e un autore corrispondente del documento. “La cosa interessante di questo nuovo processo è che offre l’opportunità di reagire ai gas serra catturati — riducendo le emissioni di carbonio nell’atmosfera — creando questa materia prima chimica critica utilizzando un catalizzatore economico e un’energia rinnovabile sotto forma di luce solare invece di utilizzare combustibili fossili.”
Carter è anche vice cancelliere esecutivo e prevosto dell’UCLA.
John Mark Martirez, un assistente scienziato del progetto UCLA, ha eseguito l’analisi meccanica quantistica della reazione, mostrando il processo passo-passo, atomo per atomo della reazione chimica che crea i gas.
Il primo autore dello studio è Linan Zhou, uno studioso post-dottorato a Rice. Altri autori senior includono professori da Rice, Naomi Halas e Peter Nordlander, e da UC Santa Barbara, guidato da Phillip Christopher.
La ricerca è stata sostenuta dall’Air Force Office of Scientific Research tramite il Department of Defense multidisciplinary university research initiative program, e dalla Welch Foundation, che sostiene la ricerca fondamentale in chimica.