bardziej ekologiczny, prostszy sposób tworzenia syngasów
naukowcy z UCLA i Rice opracowali nową metodę produkcji ważnych gazów przemysłowych
naukowcy z UCLA Samueli School of Engineering, Rice University i UC Santa Barbara opracowali łatwiejszy i bardziej ekologiczny sposób tworzenia syngasów.
w Nature Energy opublikowano dziś opracowanie opisujące ich pracę.
gaz syntezowy (termin ten jest skrótem od „gazu syntezowego”) jest mieszaniną tlenku węgla i gazów wodorowych. Jest on używany do amoniaku, metanolu, innych chemikaliów przemysłowych i paliw. Najczęstszym procesem tworzenia gazu syntezowego jest zgazowanie węgla, które wykorzystuje parę wodną i tlen (z powietrza) w wysokich temperaturach, proces, który wytwarza duże ilości dwutlenku węgla.
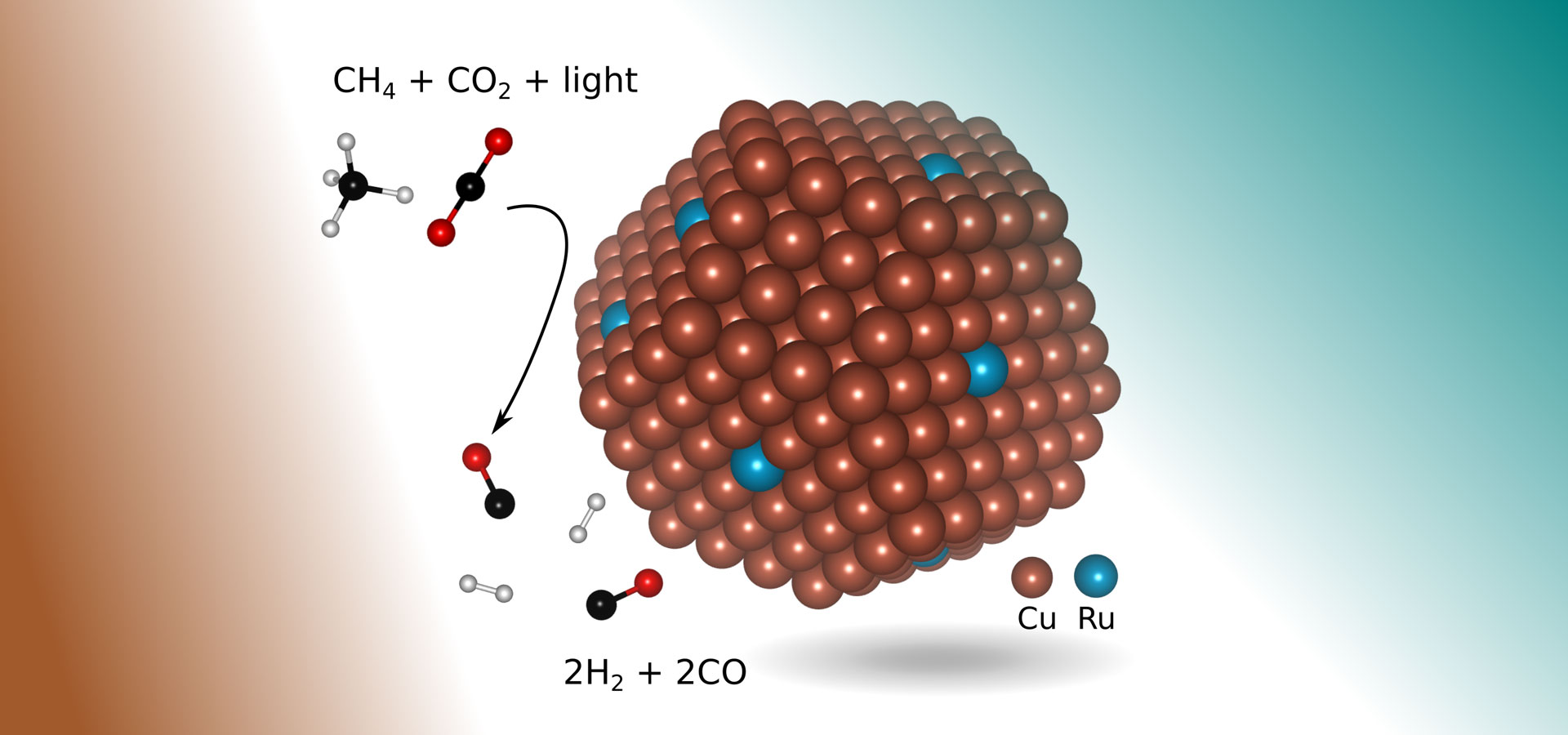
jeszcze jeden przyjazny dla środowiska sposób tworzenia gazu syntezowego, zwany suchym reformingiem metanu, polega na uzyskaniu dwóch silnych gazów cieplarnianych do reakcji — metanu (na przykład z gazu ziemnego) i dwutlenku węgla. Ale proces ten nie jest szeroko stosowany w skali przemysłowej, częściowo dlatego, że wymaga temperatur co najmniej 1300 stopni Fahrenheita (700 stopni Celsjusza) do zainicjowania reakcji chemicznej.
w ciągu ostatniej dekady naukowcy próbowali ulepszyć proces tworzenia gazu syntezowego przy użyciu różnych stopów metali, które mogłyby katalizować wymaganą reakcję chemiczną w niższych temperaturach. Ale testy były albo nieefektywne, albo skutkowały pokryciem katalizatorów metalowych koksem, pozostałością głównie węgla, która gromadzi się podczas procesu.
w nowych badaniach inżynierowie znaleźli bardziej odpowiedni katalizator: miedź z kilkoma atomami rutenu metali szlachetnych wystawionymi na działanie światła widzialnego. Nowy katalizator w kształcie małego guzka o średnicy około 5 nanometrów (Nanometr to jedna miliardowa metra) i leżący na podłożu tlenku metalu, umożliwia reakcję chemiczną, która selektywnie wytwarza gaz syntezowy z dwóch gazów cieplarnianych przy użyciu światła widzialnego do kierowania reakcją, bez konieczności dodatkowego wkładu energii cieplnej.
ponadto w zasadzie proces wymaga tylko skoncentrowanego światła słonecznego, co również zapobiega gromadzeniu się koksu, który nękał wcześniejsze metody.
 „gaz syntezowy jest wszechobecnie wykorzystywany w przemyśle chemicznym do tworzenia wielu substancji chemicznych i materiałów, które umożliwiają nasze codzienne życie”, powiedziała Emily Carter, wybitny profesor inżynierii chemicznej i biomolekularnej UCLA i odpowiednia autorka artykułu. „Ekscytujące w tym nowym procesie jest to, że Oferuje on możliwość reakcji przechwyconych gazów cieplarnianych-zmniejszając emisję dwutlenku węgla do atmosfery – podczas tworzenia tego krytycznego surowca chemicznego przy użyciu taniego katalizatora i energii odnawialnej w postaci światła słonecznego zamiast paliw kopalnych.”
„gaz syntezowy jest wszechobecnie wykorzystywany w przemyśle chemicznym do tworzenia wielu substancji chemicznych i materiałów, które umożliwiają nasze codzienne życie”, powiedziała Emily Carter, wybitny profesor inżynierii chemicznej i biomolekularnej UCLA i odpowiednia autorka artykułu. „Ekscytujące w tym nowym procesie jest to, że Oferuje on możliwość reakcji przechwyconych gazów cieplarnianych-zmniejszając emisję dwutlenku węgla do atmosfery – podczas tworzenia tego krytycznego surowca chemicznego przy użyciu taniego katalizatora i energii odnawialnej w postaci światła słonecznego zamiast paliw kopalnych.”
Carter jest również wicekanclerzem wykonawczym i rektorem UCLA.
John Mark Martirez, asystent naukowca projektu UCLA, przeprowadził kwantową analizę mechaniczną reakcji, pokazując krok po kroku, atom po atomie procesu reakcji chemicznej, która tworzy gazy.
pierwszym autorem badania jest Linan Zhou, badacz podoktorski w Rice. Inni starsi autorzy to profesorowie z Rice, Naomi Halas i Peter Nordlander oraz z UC Santa Barbara, kierowani przez Phillipa Christophera.
badania były wspierane przez Air Force Office of Scientific Research poprzez Departament Obrony multidyscyplinarny program university research initiative, oraz przez Welch Foundation, która wspiera badania podstawowe w chemii.