Un moyen plus écologique et plus simple de créer du gaz de synthèse
Des chercheurs de l’UCLA et de Rice développent une nouvelle méthode de production de gaz industriel vital
Des chercheurs de l’UCLA Samueli School of Engineering, de l’Université Rice et de l’UC Santa Barbara ont mis au point un moyen plus simple et plus écologique de créer du gaz de synthèse.
Une étude détaillant leurs travaux est publiée aujourd’hui dans Nature Energy.
Le gaz de synthèse (abréviation de « gaz de synthèse ») est un mélange de monoxyde de carbone et d’hydrogène gazeux. Il est utilisé pour fabriquer de l’ammoniac, du méthanol, d’autres produits chimiques industriels et des carburants. Le procédé le plus courant pour créer du gaz de synthèse est la gazéification du charbon, qui utilise de la vapeur et de l’oxygène (de l’air) à des températures élevées, un processus qui produit de grandes quantités de dioxyde de carbone.
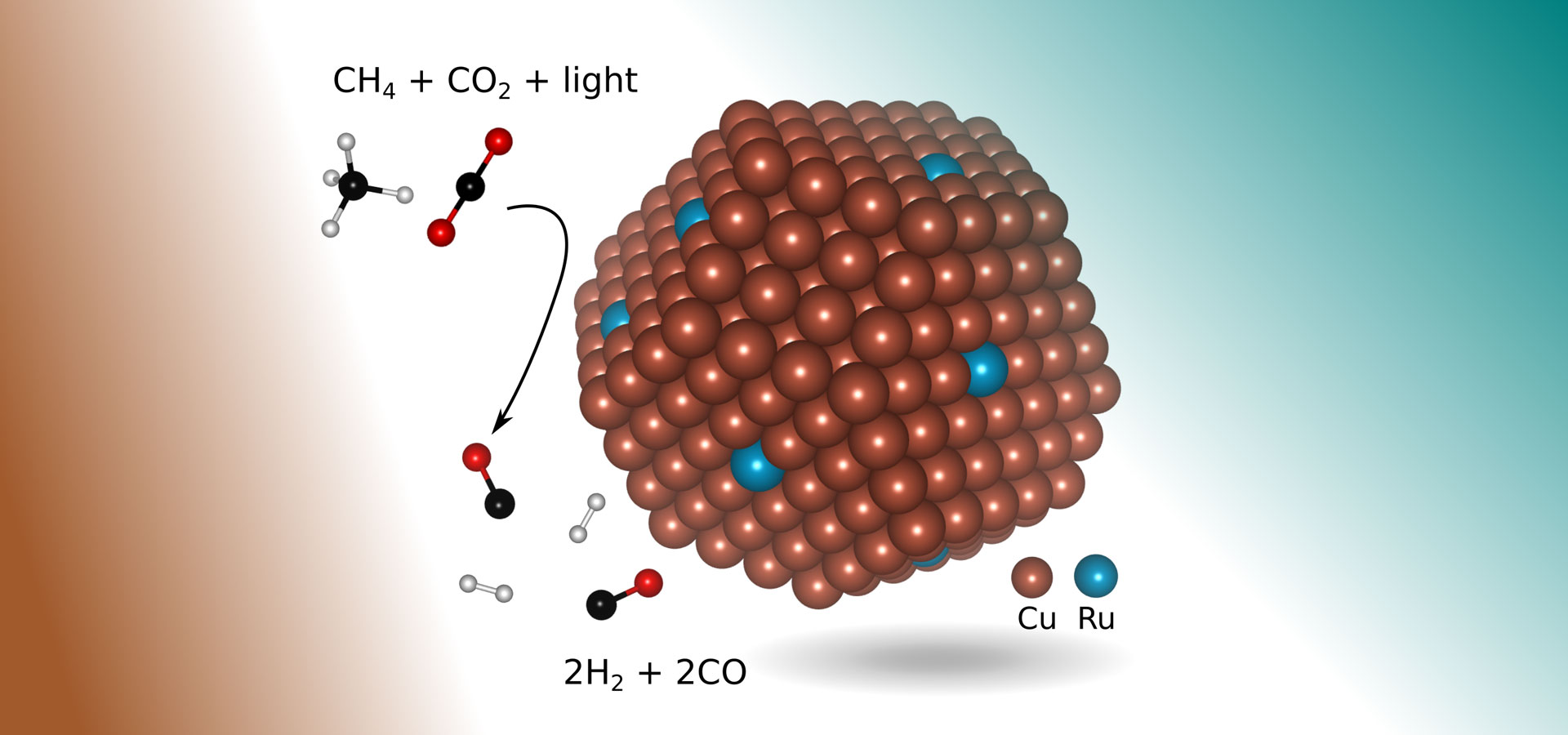
Un autre moyen écologique de créer du gaz de synthèse, appelé reformage à sec du méthane, consiste à faire réagir deux gaz à effet de serre puissants: le méthane (par exemple, du gaz naturel) et le dioxyde de carbone. Mais ce processus n’est pas largement utilisé à l’échelle industrielle, en partie parce qu’il nécessite des températures d’au moins 1 300 degrés Fahrenheit (700 degrés Celsius) pour initier la réaction chimique.
Au cours de la dernière décennie, les chercheurs ont essayé d’améliorer le processus de création de gaz de synthèse en utilisant divers alliages métalliques qui pourraient catalyser la réaction chimique requise à des températures plus basses. Mais les tests étaient soit inefficaces, soit ont abouti à la couverture des catalyseurs métalliques par du coke, un résidu de carbone principalement qui s’accumule au cours du processus.
Dans la nouvelle recherche, les ingénieurs ont trouvé un catalyseur plus approprié: le cuivre avec quelques atomes du métal précieux ruthénium exposés à la lumière visible. En forme de petite bosse d’environ 5 nanomètres de diamètre (un nanomètre est un milliardième de mètre) et posé sur un support en oxyde de métal, le nouveau catalyseur permet une réaction chimique qui produit sélectivement du gaz de synthèse à partir des deux gaz à effet de serre en utilisant la lumière visible pour piloter la réaction, sans nécessiter d’apport d’énergie thermique supplémentaire.
De plus, en principe, le procédé ne nécessite que de la lumière solaire concentrée, ce qui empêche également l’accumulation de coke qui sévissait dans les méthodes antérieures.
 « Le gaz de synthèse est utilisé de manière omniprésente dans l’industrie chimique pour créer de nombreux produits chimiques et matériaux qui facilitent notre vie quotidienne », a déclaré Emily Carter, professeure émérite de génie chimique et biomoléculaire à l’UCLA et auteure correspondante de l’article. « Ce qui est passionnant avec ce nouveau processus, c’est qu’il offre la possibilité de réagir aux gaz à effet de serre captés — en réduisant les émissions de carbone dans l’atmosphère — tout en créant cette matière première chimique essentielle en utilisant un catalyseur peu coûteux et une énergie renouvelable sous forme de lumière solaire au lieu d’utiliser des combustibles fossiles. »
« Le gaz de synthèse est utilisé de manière omniprésente dans l’industrie chimique pour créer de nombreux produits chimiques et matériaux qui facilitent notre vie quotidienne », a déclaré Emily Carter, professeure émérite de génie chimique et biomoléculaire à l’UCLA et auteure correspondante de l’article. « Ce qui est passionnant avec ce nouveau processus, c’est qu’il offre la possibilité de réagir aux gaz à effet de serre captés — en réduisant les émissions de carbone dans l’atmosphère — tout en créant cette matière première chimique essentielle en utilisant un catalyseur peu coûteux et une énergie renouvelable sous forme de lumière solaire au lieu d’utiliser des combustibles fossiles. »
Carter est également vice-chancelier exécutif et prévôt de l’UCLA.
John Mark Martirez, un scientifique de projet assistant de l’UCLA, a effectué l’analyse mécanique quantique de la réaction, montrant le processus étape par étape, atome par atome de la réaction chimique qui crée les gaz.
Le premier auteur de l’étude est Linan Zhou, chercheur postdoctoral à Rice. D’autres auteurs principaux incluent des professeurs de Rice, Naomi Halas et Peter Nordlander, et de l’Université de Santa Barbara, dirigée par Phillip Christopher.
La recherche a été soutenue par le Bureau de la Recherche scientifique de l’Armée de l’Air via le programme d’initiative de recherche universitaire multidisciplinaire du Département de la Défense, et par la Fondation Welch, qui soutient la recherche fondamentale en chimie.