Cœur artificiel
Contexte
Un cœur naturel a deux pompes, chacune avec deux chambres. L’oreillette droite pompe le sang appauvri en oxygène du corps dans le ventricule droit, qui le pompe vers les poumons. L’oreillette gauche envoie du sang aéré des poumons dans le ventricule gauche, qui le pompe vers le corps. À chaque battement cardiaque, les deux oreillettes se contractent ensemble, suivies des gros ventricules.
L’insuffisance cardiaque congestive, qui est la capacité en baisse constante du cœur à pomper le sang, est l’une des principales causes de décès. Cette maladie est causée par des dommages soudains causés par des crises cardiaques, une détérioration due à des infections virales, des dysfonctionnements des valves, une hypertension artérielle et d’autres problèmes. Selon l’American Heart Association, environ cinq millions d’Américains vivent avec une insuffisance cardiaque et plus de 400 000 nouveaux cas sont diagnostiqués chaque année. Environ 50% de tous les patients meurent dans les cinq ans. Les maladies cardiaques ont coûté environ 95 milliards de dollars à l’industrie de la santé aux États-Unis en 1998.
Bien que les médicaments et les techniques chirurgicales puissent aider à contrôler les symptômes, le seul remède contre l’insuffisance cardiaque est une greffe d’organe. En 1998, environ 7 700 Américains figuraient sur la liste nationale des transplantations cardiaques, mais seulement 30% ont reçu des greffes. Des cœurs artificiels et des dispositifs d’assistance à la pompe ont ainsi été développés comme alternatives potentielles.
Un cœur artificiel maintient la circulation sanguine et l’oxygénation du cœur pendant des périodes de temps variables. Le cœur artificiel idéal doit battre 100 000 fois toutes les 24 heures sans nécessiter de lubrification ni d’entretien et doit avoir une source d’énergie constante. Il doit également pomper plus ou moins vite en fonction de l’activité du patient sans provoquer d’infection ni de caillots sanguins.
Les deux principaux types de cœurs artificiels sont la machine cœur-poumon et le cœur mécanique. Le premier type se compose d’un oxygénateur et d’une pompe et est principalement utilisé pour maintenir la circulation du sang pendant l’opération du cœur. Cette machine ne peut fonctionner que pendant quelques heures car le sang est endommagé après des temps plus longs.
Un cœur mécanique est conçu pour réduire la charge de travail totale d’un cœur qui ne peut plus fonctionner à sa capacité normale. Ces cœurs sont constitués d’un équipement qui pulse le sang entre les battements cardiaques ou utilise un ventricule auxiliaire artificiel (dispositif d’assistance du ventricule gauche, LVAD) qui pompe une partie du débit cardiaque normal. Étant donné que de tels dispositifs entraînent généralement des complications pour le patient, ils ont généralement été utilisés comme remplacement temporaire jusqu’à ce que des cœurs naturels puissent être obtenus pour la transplantation. Dans le monde entier, environ 4 000 LVAD ont été implantés. Le marché de ces appareils est estimé à 12 milliards de dollars par an aux États-Unis.
Histoire
Depuis la fin du XIXe siècle, les scientifiques ont essayé de développer un dispositif mécanique capable de restaurer l’oxygène dans le sang et d’éliminer l’excès de dioxyde de carbone, ainsi qu’une pompe pour supplanter temporairement l’action cardiaque. Il a fallu près de 100 ans avant que la première machine cœur-poumon réussie ne soit utilisée sur un être humain par John H. Gibbon Jr. en 1953. Quatre ans plus tard, le premier cœur artificiel (en plastique) du monde occidental a été implanté à l’intérieur d’un chien. L’Institut national de cardiologie
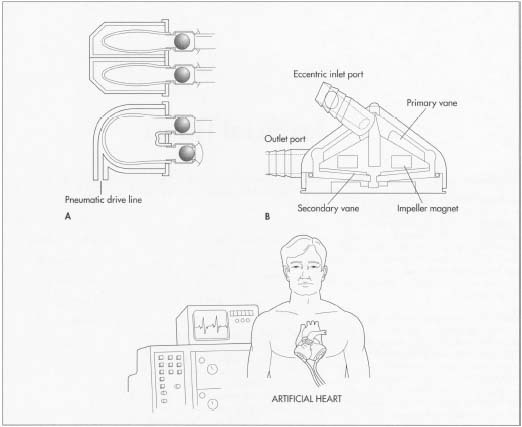
a établi le programme du cœur artificiel en 1964, menant au premier cœur artificiel total à usage humain implanté en 1969.
L’accent a été mis sur les systèmes d’assistance ventriculaire gauche et les matériaux compatibles avec le sang en 1970. Au cours de cette même année, un LVAD a été utilisé avec succès. Cependant, le développement de la pompe à sang s’est poursuivi et les dispositifs sont devenus plus petits, plus légers, plus acceptables et cliniquement efficaces. Un certain nombre de pompes en polyuréthane et en plastique de longue durée de vie ont également été développées. Au cours des années 1980, la Food and Drug Administration (FDA) a imposé des règles plus restrictives au Medical Devices Standards Act, entraînant des coûts de développement plus élevés. De nombreux groupes de recherche ont dû abandonner, il n’en reste que quelques-uns aujourd’hui.
Le scientifique le plus célèbre est peut-être le Dr Robert Jarvik, qui a inventé un cœur artificiel appelé Jarvik-7. Cet appareil, en aluminium et en plastique, a remplacé les deux chambres inférieures du cœur naturel et utilisé deux diaphragmes en caoutchouc pour l’action de pompage. Un compresseur externe de la taille d’un réfrigérateur faisait battre le cœur artificiel. Barney Clark a été le premier patient à recevoir ce cœur. Il a survécu 112 jours avant que des complications physiques causées par l’implant ne lui enlèvent la vie. En 1986, William Schroeder est devenu le deuxième récipiendaire de Jarvik-7, survivant pendant environ 20 mois.
La communauté médicale s’est rendu compte qu’un cœur complètement implantable pouvait éviter les problèmes de mobilité et d’infection causés par le Jarvik-7. En 1988, les National Institutes of Health ont commencé à financer le développement de ces cœurs et ont soutenu un tel programme en 1991, totalisant 6 millions de dollars. Trois ans plus tard, un LVAD implantable électrique et alimenté par batterie est devenu disponible. En 1999, Charlie Chappis est devenu le premier patient sorti d’un hôpital avec un tel dispositif. D’autres cœurs artificiels de différentes conceptions sont actuellement testés.
Matières premières
Un cœur artificiel ou LVAD est constitué de pièces métalliques, plastiques, céramiques et animales. Un alliage titane-aluminium-vanadium est utilisé pour la pompe et d’autres pièces métalliques car il est biocompatible et possède des propriétés structurelles appropriées. Les pièces en titane sont coulées dans un processeur spécialisé en titane. À l’exception des surfaces en contact avec le sang, le titane est usiné selon une finition spécifique. Les surfaces en contact avec le sang reçoivent un revêtement spécial de microsphères de titane qui se lient en permanence à la surface. Avec ce revêtement, les cellules sanguines adhèrent à la surface, créant une doublure vivante.
Un diaphragme en contact avec le sang dans la pompe est fabriqué à partir d’un type spécial de polyuréthane qui est également texturé pour assurer l’adhérence des cellules sanguines. Deux greffes tubulaires sont en polyester (qui sont utilisées pour fixer le dispositif à l’aorte) et les valves sont de véritables valves cardiaques retirées d’un porc. Les autres pièces qui composent le moteur sont en titane ou d’autres métaux et céramiques.
Conception
Il existe plusieurs problèmes critiques lors de la conception d’un LVAD. La dynamique des fluides du flux sanguin doit être comprise de manière à pomper suffisamment de sang et à ne créer aucun caillot sanguin. Il faut choisir des matériaux biocompatibles, sinon la pompe pourrait tomber en panne. L’efficacité du moteur doit être optimisée pour générer un minimum de chaleur. En raison d’un rejet possible, le volume total et la surface de l’ensemble de l’appareil doivent être aussi petits que possible. Un LVAD typique pèse environ 1 200 g (2,4 lb) et a un volume de 660 ml (1,4 pinte).
Robert Jarvik est né le 11 mai 1946 à Midland, Michigan, et a grandi à Stamford, Connecticut. Il entre à l’Université de Syracuse de New York en 1964, où il étudie l’architecture et le dessin mécanique. Après que son père a développé une maladie cardiaque, Jarvik est passé à la pré-médecine. Il est diplômé en 1968 avec un baccalauréat arts arts en zoologie, mais a été rejeté par les écoles de médecine aux États-Unis. Il est entré à l’Université de Bologne en Italie, mais est parti en 1971 pour l’Université de New York, obtenant une maîtrise of arts en biomécanique professionnelle.
Jarvik a postulé pour un emploi à l’Université de l’Utah. Le directeur de l’Institut de Génie Biomédical et de la Division des Organes Artificiels, Willem Kolff, développait un cœur artificiel depuis le milieu des années 1950. Jarvik a commencé comme assistant de laboratoire, obtenant son diplôme de médecine en 1976.
Le 2 décembre 1982, les médecins ont transplanté le premier cœur artificiel dans un humain. Ce dispositif en plastique et en aluminium, le Jarvik-7, a été implanté dans Barney Clark, qui a survécu pendant 112 jours après l’opération. Plusieurs autres patients ont reçu des cœurs Jarvik-7, mais aucun n’a vécu plus de 620 jours. Les principaux avantages étaient qu’il n’y aurait pas d’attente pour un cœur humain et qu’il n’y avait aucune chance de rejet. L’écueil évident étant que les patients étaient connectés à jamais à une machine à air comprimé via des tubes.
Le Jarvik-7 a finalement été utilisé comme mesure d’arrêt pour les patients en attente de cœurs naturels et a permis d’espérer qu’il n’y aurait pas d’attente pour les greffes. En 1998, Jarvik a poursuivi ses travaux sur un dispositif autonome à implanter dans le cœur malade d’une personne pour le faire fonctionner correctement.
Le processus de fabrication
-
1 La plupart des composants sont fabriqués selon des spécifications personnalisées par des fabricants tiers, y compris des ateliers d’usinage et des fabricants de cartes de circuits imprimés. Les valves porcines sont cousues à l’intérieur des greffes avec des sutures dans une entreprise de dispositifs médicaux spécialisée dans les valves cardiaques.
Une fois tous les composants obtenus, le système LVAD est assemblé et testé, afin de s’assurer que chaque appareil répond à toutes les spécifications. Une fois testé, le LVAD peut être stérilisé et emballé pour l’expédition.
Formation des pièces en polyuréthane
- 2 Certains fabricants de cœurs artificiels fabriquent leurs propres pièces en polyuréthane. Un procédé utilise une solution liquide exclusive qui est versée sur un mandrin en céramique couche par couche. Chaque couche est chauffée et séchée jusqu’à ce que l’épaisseur désirée soit atteinte. La pièce est ensuite retirée du mandrin et inspectée. Sinon, un fabricant tiers utilise un procédé de moulage par injection ou de moulage sous vide combiné à un soudage par radiofréquence.
Assemblage
- 3 Chaque cœur artificiel prend plusieurs jours pour être assemblé et testé. Le processus d’assemblage est effectué dans une salle blanche pour éviter toute contamination. Chaque cœur artificiel se compose de jusqu’à 50 composants qui sont assemblés à l’aide d’adhésifs spéciaux. Ces adhésifs nécessitent un durcissement à haute température. Plusieurs opérations d’assemblage se déroulent en parallèle, notamment l’assemblage du carter moteur et des composants, l’assemblage du tube percutané et la fixation des plaques pousseuses sur la membrane en polyuréthane. Ces sous-systèmes sont inspectés individuellement, puis l’assemblage final du système complet a lieu. Les greffons sont assemblés séparément et fixés pendant le fonctionnement.
Essais
- 4 Une fois l’assemblage terminé, chaque appareil est testé à l’aide d’un équipement spécial qui simule les pressions dans le corps. Tous les composants électroniques sont testés avec un équipement de test électronique pour assurer le bon fonctionnement de tous les circuits.
Stérilisation / emballage
- 5 Une fois le cœur artificiel testé et réussi, il est envoyé à un service extérieur pour stérilisation. Chaque appareil est scellé dans des plateaux en plastique et retourné au fabricant du cœur. Il est ensuite emballé dans des valises personnalisées pour le protéger de la contamination et éviter les dommages.
Contrôle qualité
La plupart des composants ont déjà passé l’inspection avant d’arriver chez le fabricant du cœur. Certains composants sont encore inspectés dimensionnellement car ils nécessitent des tolérances serrées — de l’ordre du millionième de pouce, ce qui nécessite des outils de mesure spéciaux. Pour répondre aux réglementations de la FDA, chaque composant (y compris les adhésifs) utilisé dans le processus est contrôlé par lot et numéro de série afin que des problèmes de suivi soient possibles.
Sous-produits / Déchets
Les déchets de titane sont récupérés et recyclés après refusion et refonte. Sinon, peu de déchets sont produits puisque la plupart des composants ont passé l’inspection avant de quitter les différents fabricants. Les autres pièces défectueuses sont jetées. Une fois qu’un appareil a été utilisé par un patient, il est renvoyé au fabricant du cœur pour analyse afin d’améliorer la conception.
L’avenir
Au cours de la prochaine décennie, un certain nombre de nouveaux appareils seront commercialisés. Des chercheurs de l’Université d’État de Pennsylvanie développent un cœur électromécanique alimenté par une énergie radiofréquence transmise par la peau. Un moteur entraîne des plaques de poussée, qui alternent en appuyant sur des sacs en plastique remplis de sang pour simuler le pompage. Les patients portent une batterie pendant la journée et dorment avec l’appareil branché à une prise électrique. Ce cœur artificiel sera testé chez l’homme d’ici 2001.
Plusieurs groupes de recherche développent des pompes qui font circuler le sang en continu, plutôt que d’utiliser une action de pompage, car ces pompes sont plus petites et plus efficaces. En Australie, Micromedical Industries Limited développe une pompe à sang rotative à flux continu, qui devrait être implantée chez un humain d’ici 2001. Le département de cardiologie de l’Université d’État de l’Ohio développe une pompe en plastique de la taille d’une rondelle de hockey qui s’autorégule. Cette pompe est implantée chez les patients pendant plusieurs semaines jusqu’à ce que leur propre cœur se rétablisse.
Thermo Cardiosystems, Inc. travaille également sur un LVAD avec une pompe rotative à débit continu), qui devrait être implanté dans le courant de l’année 2000, et un LVAD avec une pompe centrifuge à débit continu. Cette dernière en est encore à une phase de développement précoce, mais devrait être la première pompe sans support au monde, ce qui signifie qu’elle n’aura aucune pièce qui s’use. Ceci est réalisé en suspendant magnétiquement le rotor de la pompe. Ces deux dispositifs seront disponibles avec transfert d’énergie transcutanée, ce qui signifie que les dispositifs seront entièrement implantables.
Avec moins de cœurs de donneurs disponibles, d’autres développent également un cœur artificiel qui est un remplacement permanent. Ces remplacements peuvent se présenter sous la forme d’un dispositif d’assistance au ventricule gauche ou d’un cœur artificiel total, en fonction de l’état physique du patient. Les LVAD sont développés par l’inventeur Robert Jarvik et le célèbre chirurgien cardiaque Michael DeBakey. Les cœurs artificiels totaux sont développés conjointement par l’Institut de cardiologie du Texas et Abiomed, Inc. dans le Massachusetts. Au Japon, des chercheurs développent des cœurs artificiels totaux basés sur un système de robinet à tournant sphérique en silicone et une pompe centrifuge avec un système de roulement en céramique d’alumine et des composants en polyéthylène.
Des alternatives aux cœurs artificiels et aux pompes d’assistance cardiaque sont également en cours de développement. Par exemple, une pince spéciale a été inventée qui modifie la forme d’un cœur malade, ce qui devrait améliorer l’efficacité du pompage jusqu’à 30%. Un tel dispositif nécessite une chirurgie invasive minimale pour l’implantation.
Où en savoir plus
Périodiques
Bonfield, Tim. « Dispositif pour Aider les cœurs. » Cincinnati Enquirer (7 novembre 1999).
Castor, Tasha. « L’Unité de Cardiologie de l’Université d’État de l’Ohio va essayer la Pompe Cardiaque. »La Lanterne (6 mai 1999).
« Coeurs électriques d’ici 2005. »Popular Mechanics (mars 1997).
Gugliotta, Guy. « Optimiste sur les Cœurs Fabriqués par l’Homme: Des Dispositifs Améliorés Les Préservent Également pour la transplantation. » The Washington Post (28 juin 1999) : AOl.
Guy, T. Sloane. « Évolution et État actuel du Cœur Artificiel Total: La Recherche se Poursuit. »ASAIO Journal (janvier-février 1998): 28-33.
Salle, Célia. « Une Pompe De La Taille D’Un Pouce Peut Réduire Les Décès Cardiaques. »The Daily Telegraph (13 septembre 1999): 11.
Hesman, Tina. « La Pompe Apporte de nouvelles attentes pour le Cœur Artificiel. » Omaha World-Herald (12 décembre 1999).
Hopkins, Elaine. « L’appareil Permet Au Patient Cardiaque D’Attendre La greffe à la maison. »Journal Star (30 novembre 1999).
Kinney, David. « Un Cœur Artificiel Efficace Semble À Portée De Main. » The Los Angeles Times (23 janvier 2000).
Kolff, William. « Premières années d’Organes Artificiels à la Cleveland Clinic: Partie II: Chirurgie à Cœur Ouvert et Cœurs Artificiels. »ASAIO Journal (mai-juin 1998): 123-128.
Kolff, William. « La Nécessité de Faciliter la Fabrication des Cœurs Artificiels et des Dispositifs d’Assistance et la Manière dont la Technique de Moulage Sous Vide Peut Répondre à Ce Besoin. »ASAIO Journal (janvier-février 1998): 12-27.
Kunzig, Robert. » Le Rythme Continue. »Discover (janvier 2000): 33-34.
M2 Communications. « Tests de compatibilité sanguine réussis pour le Cœur artificiel de Micromedical. » M2 PressWIRE (26 mars 1999).
Phillips, Winfred. « Le Cœur Artificiel: Histoire et Statut actuel. »Journal of Biomechanical Engineering (novembre 1993): 555-557.
Takami, Y. et al. « Progrès actuels dans le développement d’un Cœur Artificiel Gyro Centrifuge Totalement Implantable. »ASAIO Journal (mai-juin 1998): 207-211.
Wilson, Steve. » Une Course à la Vie et à la Mort Contre le Temps. » Arizona Republic (14 novembre 1999).
Yambe, T. et al. « Développement du Cœur Artificiel Total avec des Avantages Économiques et de Durabilité. »The International Journal of Artificial Organs (1998): 279-284.
Autre
« Progrès sur le développement d’un Cœur artificiel. » http://www.uts.edu.au/new/archives/l999/February/02.html (29 décembre 2000).
— Laurel M. Sheppard




