Kunstherz
Hintergrund
Ein natürliches Herz hat zwei Pumpen mit jeweils zwei Kammern. Der rechte Vorhof pumpt sauerstoffarmes Blut aus dem Körper in den rechten Ventrikel, der es in die Lunge pumpt. Der linke Vorhof sendet belüftetes Blut aus den Lungen in den linken Ventrikel, der es in den Körper pumpt. Bei jedem Herzschlag ziehen sich die beiden Vorhöfe zusammen, gefolgt von den großen Ventrikeln.
Kongestive Herzinsuffizienz, die stetig abnehmende Fähigkeit des Herzens, Blut zu pumpen, ist eine der häufigsten Todesursachen. Diese Krankheit wird durch plötzliche Schäden durch Herzinfarkte, Verschlechterung durch Virusinfektionen, Klappenfehler, Bluthochdruck und andere Probleme verursacht. Nach Angaben der American Heart Association leben schätzungsweise fünf Millionen Amerikaner mit Herzinsuffizienz und jedes Jahr werden über 400.000 neue Fälle diagnostiziert. Etwa 50% aller Patienten sterben innerhalb von fünf Jahren. Herzkrankheiten kosteten die Gesundheitsindustrie der Vereinigten Staaten im Jahr 1998 rund 95 Milliarden US-Dollar.
Obwohl Medikamente und Operationstechniken helfen können, die Symptome zu kontrollieren, ist die einzige Heilung für Herzinsuffizienz eine Organtransplantation. Im Jahr 1998 standen rund 7.700 Amerikaner auf der nationalen Herztransplantationsliste, aber nur 30% erhielten Transplantationen. Künstliche Herzen und Pump-Assist-Geräte wurden daher als mögliche Alternativen entwickelt.
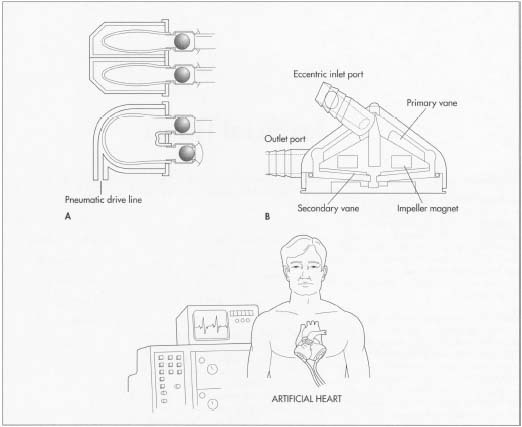
Ein künstliches Herz erhält die Durchblutung und Sauerstoffversorgung des Herzens für unterschiedliche Zeiträume aufrecht. Das ideale künstliche Herz muss alle 24 Stunden 100.000 Mal schlagen, ohne dass eine Schmierung oder Wartung erforderlich ist, und muss über eine konstante Stromquelle verfügen. Es muss auch je nach Aktivität des Patienten schneller oder langsamer pumpen, ohne eine Infektion oder Blutgerinnsel zu verursachen.
Die beiden wichtigsten Arten von Kunstherzen sind die Herz-Lungen-Maschine und das mechanische Herz. Der erste Typ besteht aus einem Oxygenator und einer Pumpe und wird hauptsächlich verwendet, um den Blutfluss aufrechtzuerhalten, während das Herz operiert wird. Diese Maschine kann nur für ein paar Stunden arbeiten, da das Blut nach längeren Zeiten beschädigt wird.
Ein mechanisches Herz wurde entwickelt, um die Gesamtarbeitsbelastung eines Herzens zu reduzieren, das nicht mehr mit seiner normalen Kapazität arbeiten kann. Diese Herzen bestehen aus Geräten, die das Blut zwischen Herzschlägen pulsieren oder einen künstlichen Hilfsventrikel (Left Ventricle Assist Device, LVAD) verwenden, der einen Teil des normalen Herzzeitvolumens pumpt. Da solche Vorrichtungen normalerweise zu Komplikationen für den Patienten führen, wurden sie im Allgemeinen als vorübergehender Ersatz verwendet, bis natürliche Herzen für die Transplantation erhalten werden können. Weltweit wurden rund 4.000 LVADs implantiert. Der Markt für diese Geräte wird in den USA auf 12 Milliarden US-Dollar pro Jahr geschätzt.
Geschichte
Seit dem späten neunzehnten Jahrhundert haben Wissenschaftler versucht, ein mechanisches Gerät zu entwickeln, das den Sauerstoff im Blut wiederherstellen und überschüssiges Kohlendioxid entfernen kann, sowie eine Pumpe, um die Herzaktivität vorübergehend zu ersetzen. Es dauerte fast 100 Jahre, bis John H. Gibbon Jr. 1953 die erste erfolgreiche Herz-Lungen-Maschine an einem Menschen einsetzte. Vier Jahre später wurde das erste künstliche Herz (aus Kunststoff) in der westlichen Welt in einen Hund implantiert. Das National Heart Institute
gründete 1964 das Kunstherzprogramm, das 1969 zum ersten künstlichen Herz für den menschlichen Gebrauch führte.
1970 verlagerte sich der Schwerpunkt auf linksventrikuläre Assistenzsysteme und blutkompatible Materialien. Im selben Jahr wurde ein LVAD erfolgreich eingesetzt. Die Entwicklung der Blutpumpen ging jedoch weiter und die Geräte wurden kleiner, leichter, akzeptabler und klinisch erfolgreich. Eine Reihe von Polyurethan- und Kunststoffpumpen mit langer Lebensdauer wurden ebenfalls entwickelt. In den 1980er Jahren hat die Food and Drug Administration (FDA) dem Medical Devices Standards Act restriktivere Regeln auferlegt, was zu höheren Entwicklungskosten führte. Viele Forschungsgruppen mussten abbrechen, heute sind es nur noch wenige.
Der vielleicht berühmteste Wissenschaftler ist Dr. Robert Jarvik, der ein künstliches Herz namens Jarvik-7 erfand. Dieses Gerät aus Aluminium und Kunststoff ersetzte die beiden unteren Kammern des natürlichen Herzens und verwendete zwei Gummimembranen für die Pumpwirkung. Ein externer Kompressor von der Größe eines Kühlschranks hielt das künstliche Herz am Schlagen. Barney Clark war der erste Patient, der dieses Herz erhielt. Er überlebte 112 Tage, bevor körperliche Komplikationen durch das Implantat sein Leben kosteten. 1986 wurde William Schroeder der zweite Jarvik-7-Empfänger und überlebte etwa 20 Monate.
Die medizinische Gemeinschaft erkannte, dass ein vollständig implantierbares Herz die durch den Jarvik-7 verursachten Mobilitäts- und Infektionsprobleme vermeiden konnte. 1988 begannen die National Institutes of Health mit der Finanzierung der Entwicklung solcher Herzen und unterstützten 1991 ein solches Programm in Höhe von insgesamt 6 Millionen US-Dollar. Drei Jahre später wurde ein elektrisches und batteriebetriebenes implantierbares LVAD verfügbar. 1999 wurde Charlie Chappis der erste Patient, der jemals mit einem solchen Gerät aus einem Krankenhaus entlassen wurde. Weitere Kunstherzen in verschiedenen Ausführungen werden derzeit getestet.
Rohstoffe
Ein künstliches Herz oder LVAD besteht aus Metall-, Kunststoff-, Keramik- und Tierteilen. Eine Titan-Aluminium-Vanadium-Legierung wird für die Pumpe und andere Metallteile verwendet, da sie biokompatibel ist und geeignete strukturelle Eigenschaften aufweist. Die Titanteile werden in einem spezialisierten Titanverarbeiter gegossen. Mit Ausnahme von blutkontaktierenden Oberflächen wird das Titan zu einem bestimmten Finish bearbeitet. Blutkontaktierende Oberflächen erhalten eine spezielle Beschichtung aus Titan-Mikrokugeln, die sich dauerhaft mit der Oberfläche verbinden. Mit dieser Beschichtung haften Blutzellen an der Oberfläche und bilden eine lebende Auskleidung.
Eine blutkontaktierende Membran innerhalb der Pumpe besteht aus einer speziellen Art von Polyurethan, das ebenfalls texturiert ist, um die Haftung der Blutzellen zu gewährleisten. Zwei röhrenförmige Transplantate bestehen aus Polyester (die zur Befestigung des Geräts an der Aorta verwendet werden), und die Klappen sind tatsächliche Herzklappen, die aus einem Schwein entfernt wurden. Andere Teile, aus denen der Motor besteht, bestehen aus Titan oder anderen Metallen und Keramiken.
Design
Beim Entwerfen eines LVAD gibt es mehrere kritische Probleme. Die Fluiddynamik des Blutflusses muss verstanden werden, damit genügend Blut gepumpt wird und keine Blutgerinnsel entstehen. Es müssen Materialien gewählt werden, die biokompatibel sind, da sonst die Pumpe ausfallen könnte. Der Wirkungsgrad des Motors muss so optimiert werden, dass nur minimale Wärme erzeugt wird. Wegen möglicher Ablehnung sollte das Gesamtvolumen und die Oberfläche der gesamten Vorrichtung so klein wie möglich gehalten werden. Ein typischer LVAD wiegt etwa 2,4 lb (1.200 g) und hat ein Volumen von 1,4 Pints (660 ml).
Robert Jarvik wurde am 11.Mai 1946 in Midland, Michigan, geboren und wuchs in Stamford, Connecticut, auf. Er trat 1964 in die New Yorker Syracuse University ein und studierte Architektur und mechanisches Zeichnen. Nachdem sein Vater eine Herzkrankheit entwickelt hatte, wechselte Jarvik zur Vormedizin. Er graduierte 1968 mit einem Bachelor of Arts in Zoologie, wurde aber von medizinischen Fakultäten in den Vereinigten Staaten abgelehnt. Er trat in die Universität von Bologna in Italien ein, ging aber 1971 an die New York University und erwarb einen Master of Arts in Occupational Biomechanics.
Jarvik bewarb sich an der University of Utah. Der Direktor des Instituts für Biomedizinische Technik und Abteilung für künstliche Organe, Willem Kolff, hatte seit Mitte der 1950er Jahre ein künstliches Herz entwickelt. Jarvik begann als Laborassistent und schloss sein Medizinstudium 1976 ab.
Am 2. Dezember 1982 transplantierten Ärzte das erste künstliche Herz in einen Menschen. Dieses Kunststoff- und Aluminiumgerät, der Jarvik-7, wurde Barney Clark implantiert, der nach der Operation 112 Tage überlebte. Mehrere andere Patienten erhielten Jarvik-7, aber keiner lebte länger als 620 Tage. Die Hauptvorteile waren, dass kein menschliches Herz gewartet werden musste und keine Chance auf Ablehnung bestand. Die offensichtliche Falle war, dass die Patienten für immer über Schläuche mit einer Druckluftmaschine verbunden waren.
Der Jarvik-7 wurde schließlich als Notlösung für Patienten eingesetzt, die auf ein natürliches Herz warteten, und gab Hoffnung, dass nicht auf Transplantationen gewartet werden müsse. 1998 setzte Jarvik die Arbeit an einem in sich geschlossenen Gerät fort, das in das erkrankte Herz einer Person implantiert werden sollte, damit es richtig funktioniert.
Der Herstellungsprozess
-
1 Die meisten Komponenten werden von Drittherstellern, einschließlich Maschinenwerkstätten und Leiterplattenherstellern, nach kundenspezifischen Spezifikationen hergestellt. Die Schweineklappen werden in einem auf Herzklappen spezialisierten Medizintechnikunternehmen mit Nähten in die Transplantate eingenäht.
Sobald alle Komponenten erhalten sind, wird das LVAD-System zusammengebaut und getestet, um sicherzustellen, dass jedes Gerät alle Spezifikationen erfüllt. Nach dem Testen kann das LVAD sterilisiert und für den Versand verpackt werden.
Umformen der Polyurethan-Teile
- 2 Einige Hersteller von Kunstherzen stellen ihre eigenen Polyurethanteile her. Ein Verfahren verwendet eine proprietäre flüssige Lösung, die Schicht für Schicht auf einen Keramikdorn gegossen wird. Jede Schicht wird erhitzt und getrocknet, bis die gewünschte Dicke erreicht ist. Das Teil wird dann vom Dorn entfernt und inspiziert. Andernfalls verwendet ein Dritthersteller ein Spritzguss- oder Vakuumformverfahren in Kombination mit Hochfrequenzschweißen.
Montage
- 3 Jedes künstliche Herz braucht mehrere Tage, um zusammengestellt und getestet zu werden. Der Montageprozess wird in einem Reinraum durchgeführt, um eine Kontamination zu vermeiden. Jedes Kunstherz besteht aus bis zu 50 Komponenten, die mit speziellen Klebstoffen zusammengefügt werden. Diese Klebstoffe erfordern eine Aushärtung bei hohen Temperaturen. Mehrere Montagevorgänge erfolgen parallel, einschließlich der Montage des Motorgehäuses und der Komponenten, der Montage des Perkutanschlauchs und der Befestigung der Druckplatten an der Polyurethanmembran. Diese Subsysteme werden einzeln inspiziert, dann erfolgt die Endmontage des Gesamtsystems. Die Transplantate werden separat zusammengebaut und während des Betriebs befestigt.
Prüfung
- 4 Nach Abschluss der Montage wird jedes Gerät mit speziellen Geräten getestet, die den Druck im Körper simulieren. Alle elektronischen Komponenten werden mit elektronischen Testgeräten getestet, um die ordnungsgemäße Funktion aller Schaltkreise sicherzustellen.
Sterilisation/Verpackung
- 5 Nachdem das künstliche Herz getestet und bestanden wurde, wird es zur Sterilisation an einen externen Dienst gesendet. Jedes Gerät wird in Kunststoffschalen versiegelt und an den Herzhersteller zurückgegeben. Es wird dann in maßgefertigten Koffern verpackt, um es vor Kontamination zu schützen und Schäden zu vermeiden.
Qualitätskontrolle
Die meisten Komponenten haben die Inspektion bereits bestanden, bevor sie beim Originalhersteller eintreffen. Einige Bauteile werden immer noch maßhaltig geprüft, da sie enge Toleranzen erfordern – in der Größenordnung von Millionstel Zoll, was spezielle Messwerkzeuge erfordert. Um die FDA-Vorschriften zu erfüllen, wird jede Komponente (einschließlich Klebstoffe), die im Prozess verwendet wird, anhand der Chargen- und Seriennummer kontrolliert, so dass Nachverfolgungsprobleme möglich sind.
Nebenprodukte/Abfälle
Titanschrott wird nach dem Umschmelzen und Umgießen zurückgewonnen und recycelt. Ansonsten wird wenig Abfall produziert, da die meisten Komponenten die Inspektion bestanden haben, bevor sie die verschiedenen Hersteller verlassen haben. Andere defekte Teile werden verworfen. Sobald ein Gerät von einem Patienten verwendet wurde, wird es zur Analyse an den Herzhersteller zurückgesandt, um das Design zu verbessern.
Die Zukunft
Innerhalb des nächsten Jahrzehnts werden eine Reihe neuer Geräte auf den Markt kommen. Forscher der Pennsylvania State University entwickeln ein elektromechanisches Herz, das von Hochfrequenzenergie angetrieben wird, die durch die Haut übertragen wird. Ein Motor treibt Druckplatten an, die abwechselnd gegen mit Blut gefüllte Plastiksäcke drücken, um das Pumpen zu simulieren. Die Patienten tragen tagsüber einen Akku und schlafen mit dem an eine Steckdose angeschlossenen Gerät. Dieses künstliche Herz wird bis 2001 am Menschen getestet.
Mehrere Forschungsgruppen entwickeln Pumpen, die Blut kontinuierlich zirkulieren lassen, anstatt eine Pumpwirkung zu verwenden, da diese Pumpen kleiner und effizienter sind. In Australien entwickelt Micromedical Industries Limited eine kontinuierliche Rotationsblutpumpe, die voraussichtlich bis 2001 in einen Menschen implantiert wird. Die kardiologische Abteilung der Ohio State University entwickelt eine Kunststoffpumpe von der Größe eines Hockeypucks, die sich selbst reguliert. Diese Pumpe wird Patienten mehrere Wochen lang implantiert, bis sich ihr eigenes Herz erholt.
Thermo Cardiosystems, Inc. arbeitet auch an einem LVAD mit einer kontinuierlichen Durchflussrotationspumpe), das voraussichtlich irgendwann im Jahr 2000 implantiert wird, und einem LVAD mit einer kontinuierlichen Durchflusskreiselpumpe. Letztere befindet sich noch in einer frühen Entwicklungsphase, soll aber die weltweit erste lagerlose Pumpe sein, d.h. keine Verschleißteile aufweisen. Dies wird erreicht, indem der Rotor der Pumpe magnetisch aufgehängt wird. Beide Geräte werden mit transkutaner Energieübertragung erhältlich sein, was bedeutet, dass die Geräte vollständig implantierbar sind.
Da immer weniger Spenderherzen zur Verfügung stehen, entwickeln andere auch ein künstliches Herz, das einen dauerhaften Ersatz darstellt. Diese Ersetzungen können je nach körperlicher Verfassung des Patienten in Form eines linksventrikulären Hilfsgeräts oder eines künstlichen Totalherzens erfolgen. LVADs werden vom Erfinder Robert Jarvik und dem renommierten Herzchirurgen Michael DeBakey entwickelt. Diese künstlichen Herzen werden gemeinsam vom Texas Heart Institute und Abiomed, Inc. entwickelt. in Massachusetts. In Japan entwickeln Forscher künstliche Totalherzen, die auf einem Silikonkugelventilsystem und einer Kreiselpumpe mit einem Lagersystem aus Aluminiumoxidkeramik- und Polyethylenkomponenten basieren.
Alternativen zu Kunstherzen und Herzunterstützungspumpen sind ebenfalls in der Entwicklung. Zum Beispiel wurde eine spezielle Klemme erfunden, die die Form eines erkrankten Herzens verändert, was die Pumpeffizienz um bis zu 30% verbessern soll. Eine solche Vorrichtung erfordert eine minimal invasive Operation zum Implantieren.
Weitere Informationen
Zeitschriften
Bonfield, Tim. „Gerät, um Herzen zu helfen.“ Cincinnati Enquirer (7. November 1999).
Castor, Tasha. „Ohio State University Cardiology Unit gesetzt Herzpumpe zu versuchen.“ Die Laterne (6. Mai 1999).
„Elektrische Herzen von 2005.“ Popular Mechanics (März 1997).
Gugliotta, Guy. „Optimistisch über menschengemachte Herzen: Verbesserte Geräte retten diejenigen, die für eine Transplantation zu klein sind.“ Die Washington Post (28.Juni 1999): AOl.
Mann, T. Sloane. „Entwicklung und aktueller Status des gesamten künstlichen Herzens: Die Suche geht weiter.“ ASAIO Journal (Januar-Februar 1998): 28-33.
Halle, Celia. „Eine daumengroße Pumpe kann den Herztod senken.“ Der Daily Telegraph (13.September 1999): 11.
Hesman, Tina. „Pumpe bringt neue Erwartungen für künstliches Herz.“ Omaha World-Herald (12. Dezember 1999).
Hopkins, Elaine. „Mit dem Gerät können Herzpatienten zu Hause auf eine Transplantation warten.“ Journal Star (30. November 1999).
Kinney, David. „Ein wirksames künstliches Herz scheint in Reichweite.“ Die Los Angeles Times (23.Januar 2000).
Kolff, Wilhelm. „Frühe Jahre künstlicher Organe an der Cleveland Clinic: Teil II: Operation am offenen Herzen und künstliche Herzen.“ ASAIO Journal (Mai-Juni 1998): 123-128.
Kolff, Wilhelm. „Die Notwendigkeit einer einfacheren Herstellung von künstlichen Herzen und Assistenzgeräten und wie dieser Bedarf durch die Vakuumformtechnik gedeckt werden kann.“ ASAIO Journal (Januar-Februar 1998): 12-27.
Kunzig, Robert. „Der Beat geht weiter.“ Discover (Januar 2000): 33-34.
M2 Kommunikation. „Erfolgreiche Blutverträglichkeitstests für das künstliche Herz von Micromedical.“ M2 PressWIRE (26.März 1999).
Phillips, Winfred. „Das künstliche Herz: Geschichte und aktueller Status.“ Journal of Biomechanical Engineering (November 1993): 555-557.
Takami, Y. et al. „Aktueller Fortschritt bei der Entwicklung eines vollständig implantierbaren Kreiselkreisel-Kunstherzens.“ ASAIO Journal (Mai-Juni 1998): 207-211.
Wilson, Steve. „Ein Wettlauf auf Leben und Tod gegen die Zeit. “ Republik Arizona (14.November 1999).
Yambe, T. et al. „Entwicklung eines totalen Kunstherzens mit wirtschaftlichen und Langlebigkeitsvorteilen.“ Das Internationale Journal für künstliche Organe (1998): 279-284.
Andere
„Fortschritte bei der Entwicklung eines künstlichen Herzens.“ http://www.uts.edu.au/new/archives/l999/February/02.html (Dezember 29,2000).
— Lorbeer M. Sheppard




